Reakce základních anorganických iontů
Úvod
Jedním ze stěžejních úkolů chemie je důkaz a stanovení základních anorganických kationtů či aniontů. Důkaz (kvalitativní analýza) obvykle předchází následující stanovení (kvantitativní analýzu). Cílem kvalitativní analýzy je určení přítomnosti jednotlivých složek v analyzovaném vzorku. Ve vodných roztocích se kvalitativní analýza provádí obvykle přímo u ostatních materiálů je potřeba nejprve získat vhodný vzorek pro analýzu (kovy a slitiny rozpouštíme, horniny a minerály tavíme či pečeme a následně rozpouštíme, organické materiály spalujeme či mineralizujeme).
Pro důkaz volíme vhodnou analytickou reakci, po níž požadujeme, aby byla sledovatelná, dostatečně rychlá, citlivá a co nejvíce specifická. Nejčastěji se používají reakce spojené se vznikem sraženin, změnou zbarvení či vývojem charakteristického plynu. Z hlediska mechanismu lze při důkazu základních iontů používat reakce acidobazické ale zejména srážecí, redoxní a komplexotvorné. Podle rozsahu látek, které lze reakcí dokázat se rozlišují reakce skupinové, selektivní a specifické. Skupinové reakce jsou charakteristické pro určitou skupinu látek. Selektivní reakce dovolují za předepsaných podmínek charakterizovat omezený počet složek. Vhodnou kombinací několika selektivních reakcí pak lze jednoznačně dokázat určitý ion. Specifické reakce udávají za předepsaných podmínek přítomnost jediné látky či iontu.
Skupinové reakce
Skupinové reakce jsou hlavním vodítkem kvalitativní analýzy a dovolují charakterizovat přítomnost určité skupiny iontů v roztoku, na něž potom zkoušíme selektivní reakce. Srážecí skupinové reakce také slouží k oddělování jednotlivých skupin iontů. Skupinové reakce slouží k tomu, abychom nepřehlédli přítomnost některé složky v roztoku a usnadňují volbu selektivních činidel.
činidlo |
skupina kationtů |
činidlo |
skupina aniontů |
zř. HCl |
neroz. chloridy |
Ba2+ |
neroz. soli |
zř. H2SO4 |
neroz. sírany |
Ag+ |
neroz. soli |
1M - štavelová |
pro Ca2+ |
KMnO4 (kys.) |
redukující anionty |
Na2CO3 |
těžké kovy |
I2 |
redukující anionty |
(NH4)2S |
těžké kovy |
KI (kys.) |
oxidující anionty |
H2S |
sulfidy neroz. v kysel. |
HCl |
těkající plyny |
KOH |
neamfoterní hydrox. |
||
NH3 (aq) |
zás. soli, roz. amosoli |
||
K2CrO4 |
|||
Na2HPO4 |
|||
KI |
Následující přehledy jsou zaměřeny jen na běžné ionty a nejsou proto zcela úplné!
Skupinové reakce kationtů
Zředěná HCl
Ag+ - bílá sraženina rozpustná v NH3 (aq) na světle fialoví, šedne až černá
Hg22+ - bílá sraženina, amoniakem černá
Pb2+ - bílá sraženina, v horké vodě snadno rozpustná, amoniakem nerozpustná
Zředěná H2SO4
Pb2+ - bílá kr. sraženina, rozpustná v octanu amonném, sirovodíkem černá
Ca2+ - bílá kr. sraženina, vzniká jen z koncentrovaných roztoků, snáze se utvoří přidáním alkoholu
Kyselina štavelová
Ca2+ - bílá kr. sraženina
Hg22+ - bílá sraženina
Ag+ , Pb2+ - bílé sraženiny neochotně rozpustné v nadbytku činidla (lze oddělit srážením HCl a sraženinu odfiltrovat)
Sirovodík (srážení nerozpustných sulfidů z kyselého prostředí)
Ag+ - černá sraženina, nerozpustná v amoniaku a sulfidu amonném
Pb2+ - černá sraženina, nerozpustná a sulfidu amonném
Hg22+ - černá sraženina
Hg2+ - černá sraženina, nerozpustná v horké zředěné kys. dusičné (liší se od ostatních sulfidů)
Cu2+ - černá sraženina, rozpustná v kys. dusičné za tepla
Bi3+ - černohnědá sraženina
Cd2+ - žlutá sraženina, barva závisí na pH roztoku
Zn2+ - bílá sraženina jen se slabě kyselých roztoků!
Sulfid amonný
sráží všechny kationy vyjma alkalických kovů a kovů alkalických zemin, tedy sráží i předchozí skupinu, avšak některé z nich jsou v nadbytku sulfidu rozpustné a vyloučí se zpět až okyselením
Co2+ - černá sraženina
Ni2+ - černá sraženina
Zn2+ - bílá sraženina
Fe2+ - černá sraženina, postupně oxiduje a hydrolyzuje na hnědý hydroxid
Fe3+ - černá sraženina, postupně hydrolyzuje na hnědý hydroxid
Cr3+ - špinavě zelená sraženina hydroxidu
Al3+ - bílá rosolovitá sraženina hydroxidu
Alkalický hydroxid
sráží většinu kationtů (vyjma alkalických kovů a kovů alkalických zemin) jako hydroxidy, které u ušlechtilejších kovů snadno hydratují za vzniku oxidů, teoreticky se všechny hydroxidu v nadbytku rozpouštějí na hydroxosloučeniny (ty které se rozpouštějí nad pH = 14 označujeme jako neamfoterní a ve vodném roztoku nedosáhneme jejich rozpuštění – Co2+ , Fe3+ , Bi3+ , Cu2+ , Ni2+ , Cd2+ , Mg2+ ).
Ag+ - hnědá sraženina Ag2O
Pb2+ - bílá sraženina rozpustná v nadbytku
Hg22+ - černá sraženina, směsi oxidů a rtuti
Hg2+ - žlutá sraženina HgO
Cu2+ - modrá sraženina, povařením přechází na hnědočerný CuO
Bi3+ - bílá sraženina, za varu se vylučuje žlutá sraženina BiO(OH)
Cd2+ - bílá sraženina, rozpustná v amoniaku
Co2+ - modrá sraženina, dalším přidáváním růžoví, na vzduchu hnědne
Ni2+ - světle zelená sraženina, amoniakem se rozpouští na fialově modrý roztok
Zn2+ - bílá sraženina, snadno rozpustná v kyselinách, nadbytkem se rozpouští v alkalických hydroxidech (od pH = 13,4)
Fe2+ - bílá sraženina, okamžitě oxiduje, zelená a hnědne až na hydroxid železitý
Fe3+ - hnědá sraženina (rez), která se v přítomnosti organických hydroxysloučenin (kyseliny vinná, citronová, glukoza, glycerin) snadno rozpouští, čehož lze využít pro maskování Fe3+ iontů
Cr3+ - šedozelená sraženina, rozpustná v kyselinách i přebytku činidla
Al3+ - bezbarvá rosolovitá sraženina amfoterní povahy, organické polydroxysloučeniny zamezují srážení hydroxidu
Ca2+ - bílá sraženina slabě rozpustná ve vodě (1,2 g na 1 l při 20° C)
přehled iontů nerozpustných v nadbytku 2M alkalického hydroxidu
Ag+ , Ca2+ , Hg2+ , Hg22+ , Co2+ , Cd2+ , Ni2+ , Cu2+ , Fe2+ , Bi3+ , Fe3+
přehled iontů rozpustných v nadbytku 2M alkalického hydroxidu
Pb2+ , Zn2+ , Al3+ , Cr3+
přehled iontů, jejichž oxidace kapkou H2 O2 je doprovázena barevnou změnou
Bi3+ , Pb2+ , Co2+ , Fe2+
Reakce s amoniakem
Ag+ - černohnědá sraženina Ag2O v nadbytku se snadno rozpouští [Ag(NH3)2]+, který stáním poskytuje krystaly třaskavého stříbra
Hg22+ - černá sraženina nerozpustná v nadbytku amoniaku
Hg2+ - bílá sraženina amidosoli špatně rozpustná v přebytku
Cu2+ - světle zelená sraženina v nadbytku se rozpouští na fialověmodrý roztok [Cu(NH3)4]2+
Cd2+ - bílá sraženina v nadbytku rozpustná na bezbarvý [Cd(NH3)4]2+
Co2+ - modrá sraženina v nadbytku rozpustná na hnědožluté roztoky (luteo-soli)
Ni2+ - světle modrá sraženina v nadbytku snadno přechází na modré roztoky [Ni(NH3)4]2+
Fe2+ - velmi snadno poskytuje přímo oxidací vzdušným kyslíkem sraženiny hydroxidu železitého
Fe3+ - hydroxid železitý
Zn2+ - obtížné srážení hydroxidu zinečnatého, který se může rozpouštět v nadbytku činidla
přehled nerozpustných sraženin
Bi3+, Pb2+, Hg22+, Hg2+, Fe3+ , Fe2+ , Cr3+ , Al3+
přehled rozpustných sraženin
Ag+, Cu2+, Cd2+, Co2+, Ni2+, Zn2+, Mn2+
Reakce s Na2HPO4
fosforečnany jsou většinou nerozpustné ve vodě, rozpustné jsou pouze fosforečnany alkálií s výjimkou lithného, srážíme činidlem a sledujeme rozpustnost vzniklé sraženiny ve zředěné kys. dusičné, octové, chlorovodíkové, v amoniaku a alkalickém hydroxidu, podle chování lze kationty rozdělit do čtyř skupin
ve zředěné kyselině octové se nerozpouštějí
Bi3+, Fe3+, Al3+, Ag+, Hg22+
v 0,1M HCl či 0,1M HNO3 jsou špatně rozpustné fosforečnany
Bi3+
v koncentrovaném amoniaku se rozpouští
Ag+, Cu2+, Cd2+, Co2+, Ni2+, Zn2+, Mn2+
v koncentrovanějším alkalickém hydroxidu se snadno rozpouštějí
Pb2+, Zn2+, Al3+, Cr3+
Reakce s jodidem draselným
Ag+ - žlutá sraženina
Pb2+ - žlutá sraženina, v přebytku činidla se snadno rozpustí, v horké vodě snadno rozpustná a opětovným ochlazením se vylučují třpytivé šupinky jodidu olovnatého (zlatý déšť)
Hg22+ - žlutohnědá sraženina
Hg2+ - červenooranžová sraženina v přebytku se rozpustí na bezbarvý tetrajodortuťnatan
Cu2+ - bílá sraženina CuI, přidáním alkoholu se rozpustí jod a vynikne barva sraženiny
Bi3+ - černohnědá sraženina snadno hydrolyzující na červený BiOI, v přebytku se rozpustí na žlutý roztok tetrajodobizmutitanu
Fe3+ - v kyselém prostředí oxiduje jodid na jod, který zbarví škrobový maz modře
Reakce s chromanem draselným
dává některé charakteristické sraženiny
Ag+ - červenohnědá sraženina
Pb2+ - žlutá sraženina
Cu2+ - hnědožlutá sraženina z neutrálního roztoku
Cd2+ - žlutavá sraženina z neutrálních roztoků za tepla
Hg22+ - červenohnědá sraženina
Hg2+ - červenohnědá sraženina
Co2+ - červenohnědá sraženina, lépe se sráží za tepla
Ni2+ - čokoládověhnědá sraženina za tepla
Zn2+ - žlutá sraženina z neutrálních roztoků
Fe2+ - žlutohnědá sraženina v kys. prostředí zelené roztoky Cr3+
Fe3+ - hnědá sraženiny
Bi3+ - žlutooranžová sraženina
Al3+ - žlutá rosolovitá sraženina jen ze slabě kyselých roztoků
Dělení skupin kationtů
Dokonalá soustava dělení katiotů již není nutným předpokladem pro dokazování jednotlivých iontů, neboť je dostatek selektivních reakcí. Dělení je tak volné a závisí na povaze vzorku. Vyhýbáme se vždy několikanásobnému postupnému dělení za sebou. Pro oddělění některých skupin kationtů lze použít tyto reakce.
1. vysrážíme-li uhličitanem amonným a sulfidem amonným vzorek v roztoku zůstanou jen ionty Na+ a K+
2. HCl vysrážíme skupinu nerozpustných chloridů Ag+ , Hg22+, Pb2+
3. H2SO4 vysrážíme skupinu nerozpustných síranů Pb2+ , Ca2+
Vybrané selektivní reakce kationtů
Na+ - velmi intenzivně barví plame žlutooranžově
K+ - plamen barví fialově (sodíkové zbarvení se filtruje modrým kobaltovým sklem); velmi málo rozpustný je chloristan draselný
Ca2+ - barví plamen oranžovočerveně, kyselina štavelová je dosti selektivním činidlem při srážení z neutrálních roztoků
Fe3+ - K2[Fe(CN)6] poskytuje ve slabě kys. prostředí modrou sraženinu berlínské modři; SCN- dávají ve slabě kyselém prostředí intenzivně červené roztoky
Co2+ - převedení na Co[CoCl4] je spolehlivá reakce, na filtrační papír naneseme 1 kapku konc. kys. chlorovodíkové a 1 kapku vzorku, a vysušíme v blízkosti plamene, za přítomnosti Co2+ vznikne modrá skvrna; rodanidy zbarvení roztoků solí kobaltnatých prohlubují
Ni2+ - Čugajevovo činidlo (dimethyldioxim, diacetylglyoxim) dává ve slabě alkalickém prostředí (pH = 7 – 9) červenou sraženinu Ni(DH)2
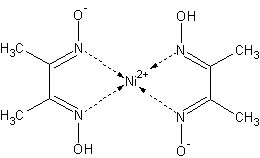
Cu2+ - K4[Fe(CN)6] dává v neutrálním či slabě kyselém prostředí červenohnědou sraženinu či roztok, pro důkaz lze využít i skutečnosti, že halogenidy či pseudohalogenidy (Br-, I-, SCN-, CN-) snadno poskytuje měďnou sůl a halogen, který lze snadno dokázat
Ag+ - jodid stříbrný je extrémně nerozpustný a v amoniakálním roztoku se odbarvuje, specificky lze AgI srážet tak, že ke kapce vzorku přidáme kapku 10% EDTA, kapku amoniaku a kapku KI, tak vzniká pouze sraženina bílého AgI, ostatní kationty jsou maskovány; typická je reakce s chromanem draselným
Zn2+ - jediný bílý sulfid ZnS; K4[Fe(CN)6] dává bílou sraženinu v neutrálním prostředí
Cd2+ - jde o poměrně vzácný prvek, typický je žlutý sulfid CdS vznikající z mírně kyselých roztoků (ostatní rušivé kationty lze maskovat CN-)
Pb2+ - vysráží se žlutý PbI2 , který se rozpustí v horké vodě, a postupně se roztok ochladí, žluté lesklé šupinky jsou specifickým průkazem přítomnosti Pb2+ iontů; sraženina síranu olovnatého po přikápnutí sulfidu sodného černá
NH4+ - silné zásady uvolňují amoniak, který lze prokázat čichem nebo ovlhčeným lakmusovým papírkem či kapkou Nesslerova činidla, která hnědne
Skupinové reakce aniontů
Důkaz aniontů je založen na skupinových a selektivních reakcích a nevyžaduje dokonalou soustavu postupného dělení, tak jak ji známe u kationtů. Řada reakcí aniontů je velmi typická a taktéž počet aniontů ve vzorcích nebývá velký. Pro srážecí reakce je potřeba odstranit všechny rušivé kationty těžkých kovů.
Skupinové reakce s Ba2+
SO42- - bílá sraženina, nerozpustná v minerálních kyselinách
CrO42- - světle žlutá sraženina, rozpustná v minerálních kyselinách
PO43- - bílá sraženina, rozpustná již v kys. octové
B(OH)4- - bílá sraženina vzniká až po přidání amoniaku, zředěné roztoky se nesráží
CO32- - bílá sraženina, rozpouští se kys. octovou za šumění (vývoj CO2)
Skupinové reakce s Ag+
CrO42- - červenohnědá sraženina, rozpustná v kys. dusičné i amoniaku
SO32- - bílá sraženina, rozpustná v kys. dusičné, amoniaku a nadbytku siřičitanu, povařením se vylučuje stříbro
PO43- - žlutá sraženina, snadno rozpustná v kys. octové i amoniaku
B(OH)4- - bílá sraženina vzniká z koncentrovaných roztoků, povařením černá, zředěné roztoky se dávají žluté až hnědé sraženiny
CO32- - žlutá sraženina, povařením vzniká oxid stříbrný a uvolňuje se oxid uhličitý
NO2- - bílá či žlutavá krystalická sraženina jen z koncentrovanějších roztoků
SO42- - bílá krystalická sraženina jen z koncentrovanějších roztoků
Cl- - bílá sraženina, rozpustná v amoniaku, na světle fialoví, šedne až černá
Br- - nažloutlá sraženina, rozpustná v koncentrovaném amoniaku
I- - žlutá sraženina, nerozpustná ve zředěné kys. dusičné v amoniaku bělá
[Fe(CN)6]4- - bílá sraženina nerozpustná ve zředěné kys. dusičné, spatně rozpustná ve zředěném amoniaku lépe v koncentrovaném, může být zabarvena hnědě přítomností [Fe(CN)6]4-
[Fe(CN)6]3- - červenohnědá sraženina, snadno rozpustná ve zředěném amoniaku
SCN- - bílá sraženina, nerozpustná ve zředěné kys. dusičné, spatně rozpustná ve zředěném amoniaku
SH- - černá sraženina
přehled stříbrných solí nerozpustných ve zředěné kyselině dusičné
Cl-, Br-, I-, SCN-, CN-, [Fe(CN)6]4-, [Fe(CN)6]3-, SH-, IO3- (z této skupiny se v amoniaku nerozpouštějí I-, SH-; špatně se amoniakem rozpouštějí Br-, SCN-, [Fe(CN)6]4-)
přehled stříbrných solí rozpustných ve zředěné kys. dusičné
CrO42-, SO32-, PO43-, B(OH)4-, CO32- (NO2-, SO42-)
Oxidace roztokem KMnO4
oxidaci manganistanem provádíme po okyselení vzorku kapičkou 1M kys. sírové, dochází-li k prokazatelné spotřebě manganistanu mohou být přítomny tyto ionty
SO32-, SH-, [Fe(CN)6]4-, Br-, I-, SCN-, CN-, NO2-
Oxidace roztokem jodu
ke vzorku přidáme roztok jodu v jodidu draselném, zrnko pevného uhličitanu sodného a kapičku škrobového mazu, je-li spotřeba jodu zřejmá, mohou být přítomny
SO32-, SH-, [Fe(CN)6]4-, CN-, (SCN-)
Redukce kyselinou jodovodíkovou
redukci provádíme jodidem draselným v kyselém prostředí
CrO42-, NO2-, [Fe(CN)6]3-, ClO3-, MnO4-, peroxidy
Anionty těkavých kyselin
při okyselení uvolňují následující anioty plynné produkty
SO32-, CO32-, CN-, NO2-
Vybrané selektivní reakce aniontů
Cl- - s Ag+ vzniká bílá sraženina, rozpustná v amoniaku, na světle fialoví, šedne až černá
SO42- - s Ba2+ vzniká v prostředí zředěné kys. dusičné nerozpustný síran barnatý
SCN- - se Fe3+ ionty dávají intenzivně červené roztoky; při oxidaci manganistanem v kyselém prostředí uniká z roztoku kyanovodík!
NO3- - vzorek (asi 1 ml) opatrně podvrstvíme několika kapkami roztoku difenylaminu v konc. kyselině sírové, podobně reagují i jiná oxidační činidla dusitany, chlorečnany, jodičnany, železité soli, manganistany, chromany, peroxidy aj., vyšší selektivity dosáhneme přidáním pevného siřičitanu sodného v prostředí 3M kys. sírové, kdy ruší pouze dusitany (dusitany lze z roztoku odstranit močovinou v prostředí 1M kys. sírové)
NO2- - s rodanidem draselným dává v okyselených roztocích červené roztoky ON.SCN, které se varem rozkládají za odbarvení; kyanoželeznatan draselný se barví v prostředí kys. octové nepatrným množstvím dusitanů žlutě (dusičnany reakci neovlivňují); chlorid amonný za horka rozkládá dusitany za vývoje dusíku; lze využít diazotaci a následnou kopulaci za vzniku diazobarviva – k rozotku aromatického aminu ve tředěné kys. octové či 0,1M HCl se přidá vodný roztok dusitanu a protřepe, po několika minutách se kopuluje s aminem či fenolem
PO43- - molybdenová soluce (7,5 g molebdenanu amonného se rozpustí za tepla v 50 ml vody a roztok se vleje do 50 ml kys. dusičné) sráží žlutou sraženinu molybdátofosforečnanu amonného, při zahřátí je rekace průkazná i u zředěných roztoků