Dělení bílkovin pomocí diskontinuální elektroforézy v polyakrylamidovém gelu (PAGE)
Při elektroforéze dochází k pohybu (migraci) iontů v elektrickém poli. Elektroforetické metody se tedy používají k separaci látek nesoucí elektrický náboj (ionty). Nositeli elektrického náboje jsou mimo jiné amfolyty (např. aminokyseliny). Ty získávají náboj (kladný nebo záporný) v důsledku jejich vnitřní disociace. Náboj aminokyselin ovlivňuje hodnota pH. Při vysokém pH dochází k ionizaci kyselých skupin a částice mají záporný náboj:
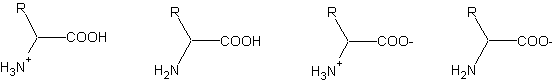
Obr 1. Různé protonační stavy aminokyselin
Při nízkém pH ionizují naopak zásadité skupiny a náboj molekuly je pak kladný. V určité oblasti pH dochází u těchto látek k disociaci stejného počtu jak kyselých tak i zásaditých skupin a celkový náboj molekuly je pak nulový. Tato hodnota pH se nazývá izoelektrický bod pI a je charakteristickou konstantou pro každý amfolyt. Aminokyseliny jsou stavebními jednotkami bílkovin a proto se bílkoviny chovají jako amfolyt. Bílkoviny jsou makromolekuly koloidní povahy a elektroforéza se často využívá k dělení těchto látek.
Příčinou pohybu koloidních částic v elektrickém poli je elektrokinetický potenciál (zeta potenciál. Jde o potenciálový rozdíl mezi pohyblivou a fixovanou částí iontové atmosféry, tj. mezi difúzně rozptýlenými ionty v roztoku a tenkou vrstvou protiiontů, poutanou k povrchu částice.
Pohyb elektricky nabitých částic závisí na jejich velikosti, tvaru, velikosti jejich náboje a na intenzitě vloženého elektrického pole . Pohyb částice je charakterizován její elektroforetickou pohyblivostí u , což je rychlost pohybu při potenciálním spádu 1V/1cm. Vztah mezi pohyblivostí a nábojem částice Q vyplývá z rovnosti hnací síly elektrické a brzdící síly třecí . Elektrická síla je dána součinem náboje částice a potenciálu pole E , v němž se částice nachází. Brzdící síla je dána vztahem B=v.f , kde v je rychlost pohybu a f je koeficient tření. Z rovnosti obou těchto sil a z definice pohyblivosti tedy plyne :
![]()
Jednotkou pohyblivosti je cm2s-1V-1.
Elektroforéza se realizuje jako volná nebo jako zónová. V případě volné elektroforézy se vzorky látek rozpustí v pufru o určitém pH a nanesou se např. na dno U-trubice. Vzorky se pak převrství pufrem o stejném pH, do kterého se vloží elektrody. Po zavedení elektrického proudu dochází k pohybu nabitých molekul k elektrodám nesoucí opačný náboj. Dělení v tomto uspořádání je zatíženo celou řadou chyb a proto byla zavedena elektroforéza zónová neboli na nosičích. Vzorky látek se v tomto případě nanášejí na vhodný nosič, čímž je např. filtrační papír, chromatografický papír, agarový gel, škrobový gel nebo polyakrylamidový gel. Nosič je pak navlhčen nebo přímo ponořen do roztoku pufru do něhož jsou rovněž zavedeny elektrody. Po zavedení elektrického proudu dochází k migraci nabitých částic k opačně nabitým elektrodám stejně jako u volné elektroforézy, ovšem pohyb se děje na nosiči, což umožňuje lepší průběh, zpracování a vyhodnocení elektroforetického dělení. Částice pak na nosiči vytváří zóny, které jsou seřazené podle elektroforetické pohyblivosti. Protože je hodnota elektrického proudu nastavena na určitou konstantní hodnotu, pohybují se zóny konstantní rychlostí, ale vytváří se stupňovitý gradient potenciálu. Projevuje se zde tzv. samozaostřující efekt. Zpozdí-li se některý ion za „svou“ zónou, tj. za zónou odpovídající příslušné pohyblivosti, octne se tak v prostředí s větší hodnotou potenciálu, který ho urychlí tak, aby dohnal svou zónu (a naopak).
V praxi se velice často používá elektroforéza v polyakrylamidovém gelu (PAGE), který je inertní, mechanicky pevný, průhledný a nabízí možnost přípravy nosiče různých předem určených vlastností (hustota zesíťování gelu, gradient hustoty gelu aj.). Polyakrylamidový gel vzniká polymerací akrylamidu a N,N-methylenbisakrylamidu (BIS), která je zahájena volnými radikály vzniklými při rozkladu persíranu amonného. Do směsi se vždy přidává stabilizátor volných radikálů TEMED (N,N,N,N-tetramethylethylendiamin).
![]()
Fyzikální vlastnosti tohoto gelu jsou dány podílem akrylamidu v gelu a stupněm zesítování. Lineární řetězce vznikají spojováním monomerů akrylamidu, příčné vazby mezi nimi jsou tvořeny BIS. Velikost pórů polyakrylamidového gelu závisí nepřímo úměrně na koncentraci akrylamidu. Čím vyšší je tedy koncentrace akrylamidu, tím jsou menší póry. Nejčastější koncentrace akrylamidu je 3 – 15 %. Koncentrace BIS obvykle odpovídá 5 % celkové koncentrace akrylamidu.
Zónovou elektroforézu lze realizovat bud v kontinuálním nebo diskontinuálním systému. Diskontinuita může být jak v koncentracích gelu, tak především v pH a iontové síle. V případě pH se diskontinuita volí použitím různé hodnoty pH pufru elektrodového a pufru v gelu. Při diskontinuální elektroforéze získáváme ostřejší zóny než v případě kontinuální elektroforézy. Jako elektrodového pufru se mimo jiné používá Tris(hydroxymethyl)-aminomethan/glycinátový pufr pH 8,3 (Tris/glycin). Gel pak obsahuje pufr Tris/HCl pH = 9,2. Po skončení elektroforézy se rozdělené bílkoviny v gelu fixují v 10 % roztoku kyseliny chloroctové a poté barví pomocí barviva CBB R-250 (Coomassie Brilliant Blue R 250). Nakonec se gel odbarví v roztoku methanolu a kyseliny octové, přičemž zóny bílkovin zůstanou zbarveny modře.