Extrakčně spektrofotometrické stanovení celkového Fe 1,10-fenanthrolinem v přírodních vzorcích
Spektrofotometrie je citlivá, experimentálně nenáročná a v mnoha případech i specifická metoda patřící ke standardním metodám chemické analýzy. Její kvantitativní provedení je založeno na platnosti Lambert-Beerova zákona, podle nějž intenzita zabarvení roztoku (měřená jako hodnota absorbance A ) dané sloučeniny je při konstantní tloušťce vrstvy měřeného roztoku d (rozměr kyvety) a konstantní vlnové délce záření přímo úměrná molární koncentraci c barevné sloučeniny v roztoku:
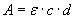
kde 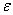 v jednotkách mol-1dm3cm-1 je tzv. molární absorpční koeficient , vyjadřující absorbanci (rel. vyjádření množství pohlceného světla) roztoku o molární koncentraci 1 mol·dm-3 v kyvetě o tloušťce 1 cm při konstantní vlnové délce dopadajícího monochromatického záření. Pro stanovení se buď určí za pomocí roztoků o známé koncentraci kalibrační křivka, s jejíž pomocí lze z hodnoty absorbance neznámého roztoku určit koncentraci stanovované látky nebo lze postupovat metodou standardního přídavku. Při ní se k analyzovanému vzorku přidá přesné množství stanovované látky (např. standardní roztok) a ze vzrůstu hodnoty absorbance oproti vzorku bez přídavku se určí opět na základě Lambert-Beerova zákona koncentrace analytu v neznámém vzorku.
v jednotkách mol-1dm3cm-1 je tzv. molární absorpční koeficient , vyjadřující absorbanci (rel. vyjádření množství pohlceného světla) roztoku o molární koncentraci 1 mol·dm-3 v kyvetě o tloušťce 1 cm při konstantní vlnové délce dopadajícího monochromatického záření. Pro stanovení se buď určí za pomocí roztoků o známé koncentraci kalibrační křivka, s jejíž pomocí lze z hodnoty absorbance neznámého roztoku určit koncentraci stanovované látky nebo lze postupovat metodou standardního přídavku. Při ní se k analyzovanému vzorku přidá přesné množství stanovované látky (např. standardní roztok) a ze vzrůstu hodnoty absorbance oproti vzorku bez přídavku se určí opět na základě Lambert-Beerova zákona koncentrace analytu v neznámém vzorku.
Řada praktických aplikací spektrofotometrie je zaměřena na stanovení anorganických látek, zejména kovů, které s vhodným činidlem mnohdy poskytují barevnou sloučeninu s vysokou hodnotou absorpčního koeficientu, nutnou pro citlivé stanovení příslušného analytu. To platí i pro železo, asi technicky nejpoužívanější kov, který však hraje důležitou roli i v biosféře. V přírodních vzorcích je však mnohdy obsah železa velmi nízký, takže ani intenzivně červeně zabarvené komplexy iontů Fe2+ s 1,10-fenanthrolinem (molární absorpční koeficient přibližně 1,1·104 mol-1dm3cm-1 při vlnové délce 512 nm) a jeho analogy neposkytují dostatečnou mez detekce pro tyto nízké koncentrace. V takových případech je nutné zakoncentrování analyzované látky. V případě spektrofotometrie lze k tomuto účelu použít extrakce z vodné fáze do malého množství organického rozpouštědla. Extrakce je založena na Nernstově rozdělovacím zákoně, který říká, že rozpuštěná látka se rozdělí mezi dvě nemísitelná rozpouštědla, která jsou ve vzájemném kontaktu, na základě její rozpustnosti v těchto rozpouštědlech. Organické látky a i komplexní sloučeniny kovů s organickým ligandem jsou obvykle lépe rozpustné v organických rozpouštědlech než ve vodě, takže i malým množstvím organického rozpouštědla lze extrahovat s vysokou účinností velké objemy vodných roztoků a tím provést zakoncentrování stanovované látky potřebné pro její citlivou analýzu.
Ne vždy lze požadovanou sloučeninu zakoncentrovat extrakcí do organické fáze, což je právě případ komplexního kationtu [Fe(phen)3]2+. V takovém případě lze ovšem extrahovatelnost daného komplexního iontu výrazně zlepšit tvorbou tzv. iontových asociátů. Jako vhodný protiion, který se podílí na přenosu žádaného iontu do organické fáze může sloužit jak malý anorganický ion, daleko častěji však objemnější organický ion. V případě zmíněného komplexního kationtu [Fe(phen)3]2+ je z anorganických aniontů vhodný např. jodid, z organických iontů např. azobarviva (methyloranž).